Experimentelle vaskuläre Neurologie Allgemein
Die Arbeitsgruppe betreibt Grundlagenforschung mit Schwerpunkt auf zerebrovaskulären Tiermodellen, neurogenetischen Untersuchungen und Stammzellforschung. Es bestehen Kooperationen mit auswärtigen Partnern.
ZEREBRALE ISCHÄMIE IM 9.4 TESLA HOCHFELD-MRT
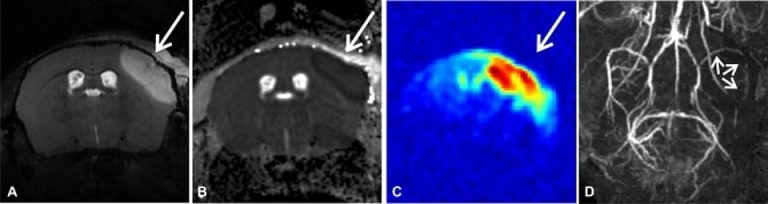
A – T1 gewichtete coronale Darstellung murinen Hirngewebes im 9.4T MRT mit hyperintensem Ischämiesignal im rechten A. cerebri media (MCA = mittlere cerebrale Hirnarterie) Stromgebiet (Pfeil) B – Korrespondierende diffusionsgewichtete Darstellung mit hypointensem Ischämiesignal C – Coronale Darstellung der Diffusion von Natrium-Ionen (rotes Signal) in murinem Hirngewebe im 9.4T MRT mit Ischämie im rechten MCA Stromgebiet (Pfeil) D – Zerebrale MR-Angiographie zeigt einen Verschluss der MCA in der rechten Hirnhemisphäre (Pfeile)
Im Rahmen unserer experimentellen Forschungsarbeiten zur Verbesserung der Akuttherapie beim Schlaganfall verwenden wir neben histologischen Analyseverfahren auch die Magnetresonanztomographie (MRT) um die Pathologien des Schlaganfalls in vivo darzustellen. Hierbei kommt ein 9,4 Tesla Hochfeld-MRT zur Anwendung, welches auf Kleintiere ausgerichtet ist. Die Verwendung einer speziellen Cryospule erhöht die Sensitivität des MRT um den Faktor 2,5, wodurch zwei- oder dreidimensionale Bilder entstehen, die trotz der winzige Gewebegröße des Maus- und Rattengehirns eine der klinisch humanen Situation gleichwertige und in manchen Belangen sogar überlegene Bilddarstellung ermöglichen. Neben seriellen in vivo Untersuchungen der Hirnschädigung und MR-Angiographien werden unsere Analysen in Kooperation mit dem Institut für Computerunterstützte Klinische Medizin (CKM, Lehrstuhl Prof. Dr. L. R. Schad) um Natrium MRT Sequenzen ergänzt. Die Messung der Diffusionsrichtung von Natrium-Ionen im Gehirn erlaubt uns möglicherweise die funktionelle Darstellung des vom Infarkt betroffenen Gebietes. Im Gegensatz zu den bisherigen Verfahren, deren Messungen sich auf Wasser beziehen, erlaubt die Darstellung von Natrium eine stärker funktionelle Analyse der pathophysiologischen Hirnprozesse.
Publikationen
- Characterization of a new model of thromboembolic stroke in C57 black/6J mice. Ansar S, Chatzikonstantinou E, Wistuba-Schier A, Mirau-Weber S, Fatar M, Hennerici MG, Meairs S. Transl Stroke Res. 2014 Aug;5(4):526-33. doi: 10.1007/s12975-013-0315-9. Epub 2013 Dec 19. PubMed PMID: 24347404; PubMed Central PMCID: PMC4092233.
- Chlorine and sodium chemical shift imaging during acute stroke in a rat model at 9.4 Tesla. Baier S, Krämer P, Grudzenski S, Fatar M, Kirsch S, Schad LR. MAGMA. 2014 Feb;27(1):71-9. doi: 10.1007/s10334-013-0398-z. Epub 2013 Aug 10. PubMed PMID: 23934160.
- Thromboembolic stroke in C57BL/6 mice monitored by 9.4 T MRI using a 1H cryo probe. Langhauser FL, Heiler PM, Grudzenski S, Lemke A, Alonso A, Schad LR, Hennerici MG, Meairs S, Fatar M. Exp Transl Stroke Med. 2012 Sep 12;4(1):18.doi: 10.1186/2040-7378-4-18. PubMed PMID: 22967955; PubMed Central PMCID: PMC3514176.
- Chemical shift sodium imaging in a mouse model of thromboembolic stroke at 9.4 T. Heiler PM, Langhauser FL, Wetterling F, Ansar S, Grudzenski S, Konstandin S, Fatar M, Meairs S, Schad LR. J Magn Reson Imaging. 2011 Oct;34(4):935-40. doi:10.1002/jmri.22700. Epub 2011 Jul 18. PubMed PMID: 21769985.
Stammzelltherapie bei zerebrovaskulären Erkrankungen
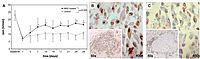
A – Mit Stammzellen behandelte Ratten (schwarze Linie) zeigen im Verhaltenstest (RotaRod-Test) gegenüber unbehandelte Ratten (hellgraue Linie) ein verbessertes motorisches Verhalten. B – Immunhistochemisch gefärbte BrdU-positive Zellen im Rattenhirn (braun) verweisen auf eine vermehrte Proliferation von neuronalen Progenitorzellen. C – Immunhistochemisch angefärbte humane Mitochondrien (braun) verweisen auf den humanen Ursprung von neuronalen Progenitorzellen
Zerebrovaskuläre Erkrankungen wie Schlaganfall, intrazerebrale Blutungen oder vaskuläre Demenz sind eine wichtige und häufige Ursache für Morbidität und Mortalität in den heutigen Industrienationen. Nachdem die rtPa-Lysetherapie in den ersten Stunden nach akuten Gefäßverschlüssen im Gehirn seit einigen Jahren möglich ist, liegt ein Schwerpunkt der aktuellen Forschung daher in der Förderung von Regeneration und Wiederaufbau geschädigten Gewebes.
Hoffnung auf eine solche Therapie gibt die Beobachtung, dass nach Schädigung von Hirnarealen neuronale Progenitorzellen aktiviert werden, welche sich zu ausdifferenzierten neuronalen Zellen weiterentwickeln. Dies wirkt sich neuroprotektiv und wachstumsstimulierend auf die geschädigten Hirnareale aus. Die Idee liegt daher nahe, durch Gabe von Stammzellen die zerstörten Zellen zu ersetzen. Verschiedenste Stammzellpopulationen (Neuronale, Mesenchymale, aus Teratomen gewonnene etc.) wurden bislang getestet und Parameter wie ihr Überleben, ihre Differenzierung oder ihr Einfluss auf das funktionelle Defizit untersucht.
Frühe Ergebnisse aus unserer Forschung zeigen, dass bei mit Stammzellen behandelten Tieren eine deutlich verbesserte Wiederherstellung der motorischen Fähigkeiten erreicht werden konnte (Fatar et al. 2008). Auch konnte eine verstärkte Zellproliferation in den Hirnen der Tiere beobachtet werden. Diese ersten Daten lassen vermuten, dass Stammzellen in der Lage sind, eine Regeneration von geschädigtem Gewebe anzuregen.
PUBLIKATIONEN
- ,,Lipoaspirate-derived adult mesenchymal stem cells improve functional outcome during intracerebral hemorrhage by proliferation of endogenous progenitor cells stem cells in intracerebral hemorrhages.” Fatar M, Stroick M, Griebe M, Marwedel I, Kern S, Bieback K, Giesel FL, Zechmann C, Kreisel S, Vollmar F, Alonso A, Back W, Meairs S, Hennerici MG. Neurosci Lett. 2008 Oct 10;443(3):174-8.doi: 10.1016/j.neulet.2008.07.077. Epub 2008 Aug 5. PubMed PMID: 18691631.
- ,,Gadofluorine m uptake in stem cells as a new magnetic resonance imaging tracking method: an in vitro and in vivo study.” Giesel FL, Stroick M, Griebe M, Tröster H, von der Lieth CW, Requardt M, Rius M, Essig M, Kauczor HU, Hennerici MG, Fatar M. Invest Radiol. 2006 Dec; 41(12):868-73. PubMed PMID: 17099425.
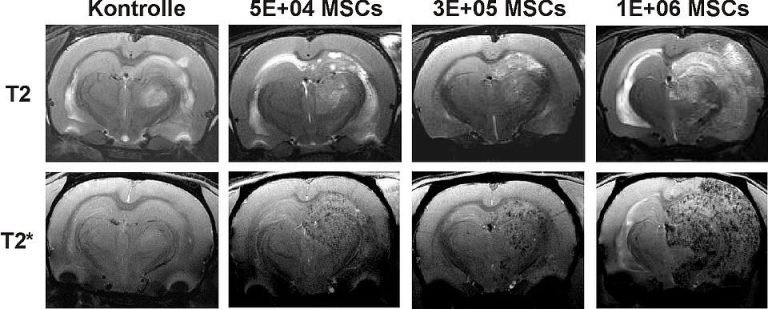
Zelltracking (Nachweis applizierter Stammzellen in vivo mittels 9.4T MRT als auch immunhistochemisch)
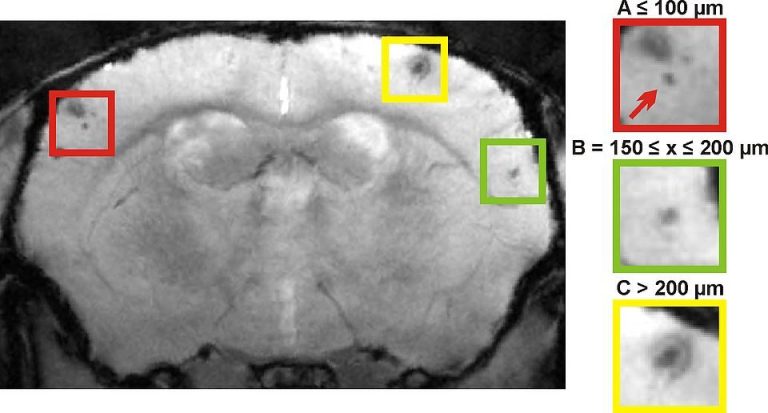
Repräsentative coronale Darstellung eines Rattenhirns nach Ischämie und anschließender Applikation von verschiedenen Mengen an mit Kontrastmittel markierten mesenchymalen Stammzellen (MSCs) im 9.4T MRT. Die Stammzellen zeigen sich in T2*-gewichteten Aufnahmen als dunkle Punkte und befinden sich ausschließlich im Ischämiegebiet der rechten Hirnhemisphäre. Das Ischämiegebiet ist in den T2-gewichteten Aufnahmen zu sehen.
Bislang konnte man vor allem mithilfe histologischer Techniken unter dem Mikroskop das Schicksal und die Lokalisation von Stammzellen untersuchen. Durch die kontinuierliche Verbesserung bildgebender Verfahren, insbesondere der Magnetresonanztomographie (MRT) mit Hochfeld-Spulen, ist eine erstaunliche Auflösung von Hirnstrukturen erreicht worden, was mittlerweile auch eine Darstellung von Zellpopulationen in vivo, d.h. im lebenden Organismus, erlaubt.
Um das Migrationsverhalten, also die Bewegung von Stammzellen nach ihrer Injektion studieren zu können, benötigt man ein Beobachtungsverfahren welches weder für die Zellen, noch für den Organismus, in welchen die Zellen eingebracht werden, toxisch ist. Die Lösung ist die Markierung der Zellen mit einem speziell für das MRT hergestellten nicht-toxischen Kontrastmittel, welche entweder aus Gadolinium-Chelate oder Eisenoxidpartikeln bestehen. Diese führen durch ihre paramagnetischen Eigenschaften zu einer Verkürzung der Relaxationszeit d.h. der Wiederausrichtung des Kernspins der Atome entlang des von außen angelegten Magnetfelds nach dem Ende des Hochfrequenzimpulses. Dadurch lassen sich mit diesen Kontrastmitteln markierte Zellen optisch leicht vom umliegenden Hirngewebe abgrenzen. Der Nachteil von früher verwendeten MRT Kontrastmitteln liegt in ihrer relativ großen Partikelgröße von bis zu 60 nm im Durchmesser. Seit wenigen Jahren verwenden wir ein neuartiges Kontrastmittel, welches im Gegensatz zu den früher verwendeten Eisenoxidpartikeln der neuesten Generation mit Partikelgrößen von nur 4-9 nm besonders geeignet für die schonende Markierung von Zellen ist. Hiermit ist es möglich, sehr sensitiv verschiedene Zellzahlen mittels MRT-Bildgebung nachzuweisen.
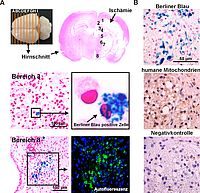
A – Repräsentative Darstellung von Hirnschnitten eines Rattenhirns nach Ischämie und anschließender Applikation von mit Kontrastmittel markierten mesenchymalen Stammzellen. Nach Berliner Blau Färbung (blaues Signal) ist das eisenhaltige Kontrastmittel deutlich im Zytoplasma der Stammzellen zu erkennen. Die Autofluoreszenz des mit Fluorescein markierten Kontrastmittels (grün im Fluoreszenzbild) kolokalisiert mit Berliner Blau positiven Stellen (blau = DAPI/Zellkerne). B – Berliner Blau positive Stellen kolokalisieren ebenfalls mit einem Marker für humane Mitochondrien (braun).
Nach der Applikation lassen sich die Stammzellen histologisch zum einen aufgrund ihres menschlichen Ursprungs mithilfe von humanen Markern und zum anderen auch anhand des Eisengehaltes des Kontrastmittels mittels der Berliner-Blau-Färbung nachweisen.
Matrix Metalloproteinasen und Schlaganfall
Matrix Metalloproteinasen (MMPs) gehören zu der Familie der Zink-Endopeptidasen und sind unter anderem an der Spaltung nahezu aller Komponenten der extrazellulären Matrix (EZM) beteiligt. Bei akuten Schlaganfällen sind sie sowohl an dem unmittelbar folgendem Zusammenbruch der Bluthirn-Schranke in wesentlichem Maße beteiligt, als auch bei den sich anschließenden regenerativen Vorgängen wie Angiogenese, Synaptogenese etc. MMP-vermittelt kommt es zu vaskulärer Ödembildung und Infiltration des Infarktareals durch neutrophile Granulozyten und Makrophagen. In den ersten Stunden handelt es sich um eine hauptsächlich MMP-2 vermittelte Sofortreaktion mit Ödembildung und möglicher sekundärer Hämorrhagie, begleitet von einem Anstieg von TIMP-2. Nach 24 - 48 Stunden wird eine zweite, noch ausgeprägtere Störung der Blut-Hirn-Schranke verzeichnet, zeitgleich mit einem deutlichen Anstieg der MMP-9 Konzentration im Plasma.
Gefördert durch das Nationale Genom Forschungsnetzwerk (NGFN) und das European Stroke Network untersuchten wir den Metalloproteinase-Stoffwechsel beim Schlaganfall in vitro mittels humaner Endothelzelllinien und in vivo mittels klinischer Beobachtungsstudien.
- Effect of Simvastatin on MMPs and TIMPs in Human Brain Endothelial Cells and Experimental Stroke. Reuter B, Rodemer C, Grudzenski S, Meairs S, Bugert P, Hennerici MG, Fatar M. Transl Stroke Res. 2014 Dec 5. [Epub ahead of print] Temporal profile of matrix metalloproteinases and their inhibitors in a human endothelial cell culture model of cerebral ischemia. Reuter B, Rodemer C, Grudzenski S, Couraud PO, Weksler B, Romero IA, Meairs S, Bugert P, Hennerici MG, Fatar M. Cerebrovasc Dis. 2013;35(6):514-20
- MMP-2 concentrations in stroke according to etionlogy: adjusting for enzyme degradation in stored deep-frozen serum and other methodological pitfalls. Kreisel SH, Stroick M, Reuter B, Senn E, Hennerici MG, Fatar M. J Clin Neurosci. 2012 Nov;19(11):1564-7
- TIMP-2 gene polymorphism is associated with intracerebral hemorrhage. Reuter B, Bugert P, Stroick M, Bukow S, Griebe M, Hennerici MG, Fatar M. Cerebrovasc Dis. 2009;28(6):558-63.
- Single-nucleotide polymorphisms of MMP-2 gene in stroke subtypes. Fatar M, Stroick M, Steffens M, Senn E, Reuter B, Bukow S, Griebe M, Alonso A, Lichtner P, Bugert P, Meitinger T, Wienker TF, Hennerici MG. Cerebrovasc Dis. 2008;26(2):113-9.
- Matrix metalloproteinases in cerebrovascular diseases. Fatar M, Stroick M, Griebe M, Hennerici M. Cerebrovasc Dis. 2005;20(3):141-51.
Molekularbiologische Mechanismen und therapeutische Möglichkeiten der zerebralen Amyloidangiopathie
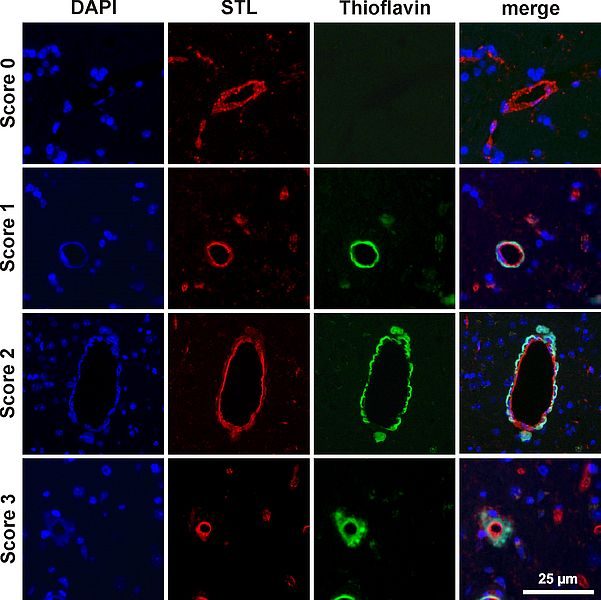
Repräsentative Darstellung und Klassifikation des Gefäßbefalls im CAA Mausmodell (Blau = Zellkerne). Solanum Tuberosum Lectin (STL) (rotes Signal) markiert alle Gefäße. Die mit Amyloid β befallenen Gefäße wurden mithilfe der Thioflavin-Färbung sichtbar gemacht (grün), so dass der prozentuale Anteil an befallenen Gefäßen erfasst werden kann. Entsprechend des Grades des Gefäßbefalls kann dieser klassifiziert werden.
Die beiden häufigsten Ursachen von Demenz sind vaskuläre Erkrankungen des Gehirns (z. B. Schlaganfall) und Morbus Alzheimer. Zunehmend wird erkannt, dass diese Veränderungen nicht unabhängig voneinander, sondern parallel stattfinden.
Ein aktueller Forschungsschwerpunkt ist die mit vaskulärer Demenz und M. Alzheimer oftmals assoziierten Zerebralen Amyloidangiopathie (CAA), eine Erkrankung des Gefäßsystems. Die Prävalenz der CAA beträgt in der älteren Bevölkerung nach pathologischen Studien 20–40% bei nicht an Demenz Erkrankten und 50–60% bei Patienten mit Demenz. Wie bei M. Alzheimer kommt es bei der CAA zu einer gehäuften Ablagerung des Proteins Amyloid β zwischen den Nervenzellen oder innerhalb der Gefäßwand. Dies führt zu einer Einschränkung der Hirnfunktion sowie der Funktion hirnversorgender Gefäße.
Eine der wenigen Mausmodelle, die die Pathologien der CAA widerspiegeln, ist die transgene Maus vom Stamm APP23, welcher auch für unsere Erforschung der CAA verwendet wird. Die Mutation, welche die APP23 Maus trägt, führt zu einer stark vermehrten Ablagerung von Amyloid β, wobei sowohl die für M. Alzheimer typischen parenchymatösen Amyloid β-Plaques als auch ein erhöhter CAA typischer vaskulärer Befall zu beobachten ist. Dieser nimmt vergleichbar zur humanen Situation mit dem Alter zu.
Repräsentative T2*-gewichtete coronale Darstellung eines Maushirns des Stammes APP23 mit für CAA typischen hypointensen Mikroblutungen im 9.4T MRT.
Obwohl schon in histopathologischen Studien in den 70er und 80er Jahren des vergangenen Jahrhunderts vermehrt die Rolle der CAA beschrieben wurde, erlebte sie in den letzten Jahren ein gesteigertes Interesse in der Forschung, u.a. auch aufgrund von verbesserten Bildgebungsverfahren, welche neben dem MRT auch die Positronen-Emissionstomographie (PET) einschließen. Mithilfe dieses Verfahrens wird es möglich sein, die Entwicklung des Amyloid-Befalls nach therapeutischer Behandlung in vivo mithilfe von Radiotracern wie 18F-Flutemetanol zu verfolgen. Zukünftige Studien in Kooperation mit dem Institut für Klinische Radiologie und Nuklearmedizin (Lehrstuhl Prof. Dr. B. Wängler; http://www.umm.uni-heidelberg.de/inst/radchem/index.html ).
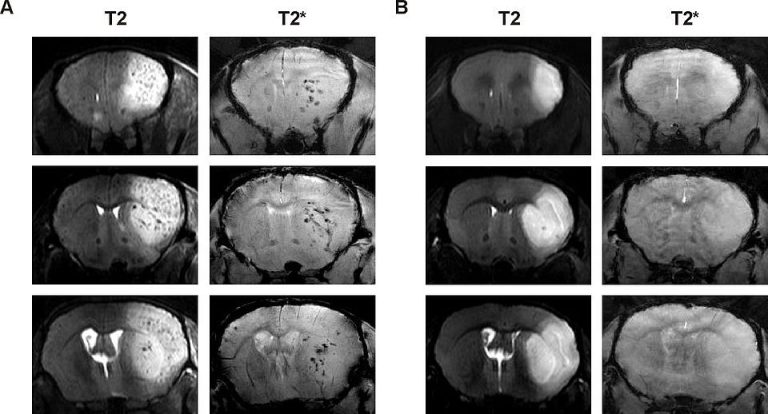
Repräsentative T2- und T2*-gewichtete coronale Darstellungen eines Maushirns des Stammes APP23 sowie eines gesunden Wildtyps im 9.4T MRT 24h nach Ischämie mit direkt anschließender Thrombolysetherapie. In der APP23-Maus können Mikroblutungen als hypointense Signale im Infarktgebiet dargestellt werden.
Vor allem bei CAA-Patienten mit krankheitsbedingtem erhöhtem Blutungsrisiko wird die Lysetherapie mit ihren bekannten Nebenwirkungen bis jetzt nicht infrage gestellt. Ein weiterer Schwerpunkt unserer Forschung unter Zuhilfenahme des CAA-Mausmodells liegt daher in der besseren Einschätzung des Risikos von ICH nach Schlaganfall und einer Thrombolysetherapie. Erste Ergebnisse lassen hierbei vermuten dass der APP23-Genotyp mit einem erhöhten Risiko für ICH nach Lysetherapie einhergeht, wodurch man auch Rückschlüsse auf das Risiko von CAA-Patienten ziehen kann.Bildlegende
T2 und T2* gewichtete repräsentative coronale Darstellung eines Maushirns des Stammes APP23 sowie eines gesunden Wildtyps (WT) im 9.4T MRT 24h nach Ischämie mit direkt anschließender Thrombolysetherapie.
Publikationen
- ,,Thrombolysis in experimental cerebral amyloid angiopathy and the risk of secondary intracerebral hemorrhage.” Reuter B, Grudzenski S, Chatzikonstantinou E, Meairs S, Ebert A, Heiler P, Schad LR, Staufenbiel M, Hennerici MG, Fatar M. Stroke. 2014 Aug;45(8):2411-6. doi: 10.1161/STROKEAHA.113.004483. Epub 2014 Jul 8. PubMed PMID: 25005438.
- ,,Long term Statin Therapy and the Development of Cerebral Microbleeds in Cerebral Amyloid Angiopathy - A Rodent in vivo Approach” Venus A, Reuter B, Grudzenski S, Heiler P, Schad LR, Staufenbiel M, Hennerici MG, Fatar M. Presentation, XXII Europ. Stroke Conference 2013, London, GB
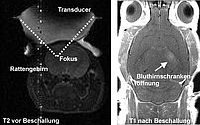
Repräsentative T2-gewichtete coronale und T1-gewichtete transversale Darstellung eines Rattenhirns im 7T MRT (CEA - DSV / I²BM / NeuroSpin, Gif-sur-Yvette, France) vor und nach MRgFUS in Kombination mit Microbubbles.
EXTERNE KOOPERATIONEN
- Montaner J, Barcelona – CAA Mausmodell
- Vivien D, Caen – Thromboemboliemodell
- Couraud PO, Paris – Endothelial Cell Culture
- Veltkamp, London
Urheberrecht © schlaganfall.org - Prof. Dr. M.G. Hennerici & Webmaster : M.R. Hennerici
Bilder fotolia: 74035623 - Stop Stroke Sign Painted, Open Hand Raised. © tashatuvango;36868741 - Schlaganfall © XtravaganT; 67101469 - Excellent Health Status Survey © Ivelin Radkov;83239124 - Teamwork! © stockpics;77601256 - Formula © olly
Alle Rechte vorbehalten.