Bewegungsstörungen
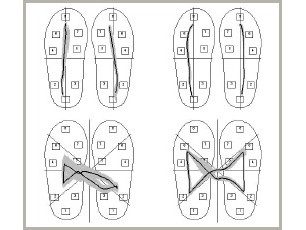
CDG bei einem Patienten mit Hemiparese rechts: linke Spalte im Akutstadium 2 Tage nach dem Schlaganfall, rechte Spalte im Verlauf nach 14 Tagen Rehabilitationsbehandlung
Die wissenschaftliche Analyse von Gang- und Bewegungsstörungen gehört seit zwanzig Jahren zu den Arbeitsgebieten unserer Klinik und wurde kontinuierlich weiterentwickelt. Das diagnostische Verfahren der Computerdynografie (CDG) dient dazu, normale Varianten und Störungen des Gehens und der Posturalkontrolle zu dokumentieren und spezifische Muster von Gangstörungen bei neurologischen Erkrankungen zu identifizieren. Die praktische Anwendung und kontinuierliche Weiterentwicklung dieser Methode seit mittlerweile mehr als 20 Jahren mit über 10.000 Einzel- und Verlaufsuntersuchungen an unserer Klinik belegt, dass mit der CDG ein praktisch anwendbares und diagnostisch aussagekräftiges Verfahren zur Ganganalyse zur Verfügung steht. Besonders geeignet ist die CDG für Verlaufsuntersuchungen, denn durch die objektive Beurteilung von Veränderungen des Gangbildes im Verlauf lassen sich subjektive Eindrücke von Ärzten, Physiotherapeuten und Patienten objektivieren und beispielsweise Krankheitsverlauf bzw. Effekte therapeutischer Maßnahmen besser einschätzen.
DREIDIMENSIONALE BEWEGUNGSANALYSE
Zur detaillierten Charakterisierung von Bewegungsstörungen wird des Weiteren ein System zur dreidimensionalen Bewegungsanalyse (CMS 70 der Firma Zebris) verwendet. Damit lassen sich über eine parallele Aufzeichnung von Bewegungsspuren in hoher zeitlicher und räumlicher Auflösung, welche auf Laufzeitmessungen von Ultraschallimpulsen basieren, sowie bis zu acht Oberflächen-EMGs detaillierte Analysen der Handmotorik und Koordination durchführen. Neben raschen Tapping-, Greif- und Zielbewegungen können so auch komplexere Bewegungsabläufe, beispielsweise das Schreiben mit einem Stift, analysiert werden. Zusätzlich kann mit diesem Verfahren eine detaillierte Tremoranalyse mit Messung der Tremorfrequenz und –amplitude sowie EMG- und Aktivierungsmustern erfolgen, welche klinisch in der Differentialdiagnose eines Tremors (z.B. M. Parkinson, essentieller Tremor und weiteren Tremorformen) wichtige Informationen liefert, aber auch wissenschaftlich z.B. zur Evaluation von Therapieverfahren verwendet wird. Das beschriebene System zur dreidimensionalen Bewegungsanalyse kann in Kombination mit einem zur Verfügung stehenden Ergometer-Laufband zudem für eine dreidimensionale Ganganalyse in Echtzeit genutzt werden. Neben den Kraftkurven und Basis-Gangparametern können so auch weitere kinematische Parameter wie Gelenkwinkel, EMG-Aktivitäten der Beinmuskulatur und Rumpfbewegungen mit hoher zeitlicher Auflösung analysiert werden.
Aktuelle Schwerpunkte
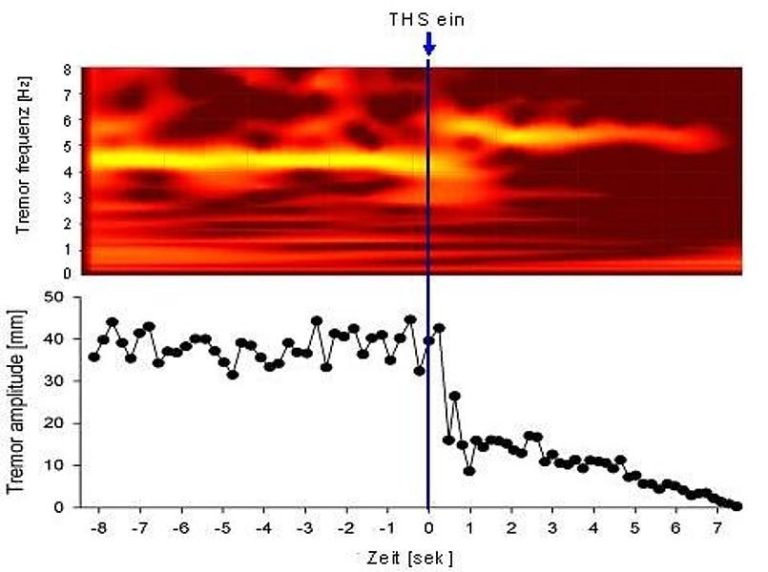
Beeinflussung der Tremorfrequenz und -amplitude durch das Wiedereinschalten der STN-Stimulation bei einem Patienten mit M. Parkinson
In enger Zusammenarbeit mit der Neurochirurgischen Universitätsklinik der Medizinischen Hochschule Hannover werden verschiedene Untersuchungen zu Effekten der tiefen Hirnstimulation bei Patienten mit unterschiedlichen Bewegungsstörungen durchgeführt. Neben M. Parkinson und essentiellem Tremor werden dabei vor allem Patienten mit einer fokalen, segmentalen oder generalisierten Dystonie evaluiert. Einerseits wird die klinische Effektivität der tiefen Hirnstimulation (THS) sowie auftretende Nebeneffekte evaluiert, andererseits mögliche Wirkmechanismen der THS erforscht. Neben einem ausführlichen klinischen Untersuchungsprotokoll mit detaillierter Videographie und Verwendung unterschiedlicher Beurteilungsskalen stehen hierfür wie oben aufgeführt moderne Meßsysteme für die quantitative Analyse des Gehens, verschiedener Hand- und Kopfbewegungen sowie für eine Tremoranalyse zur Verfügung.
Bei Patienten mit M. Parkinson liegt das Hauptaugenmerk auf der Analyse des Ruhe- und Aktionstremors und deren Beeinflussung durch eine dopaminerge Medikation sowie eine chronische tiefe Hirnstimulation des Nucleus subthalamicus (STN). Aus unseren Arbeiten lässt sich aufgrund der unterschiedlichen Beeinflussung der Tremorfrequenz und einer im Vergleich zur dopaminergen Medikation wesentlich deutlicheren Reduktion der Tremoramplitude pathophysiologisch schließen, daß die tiefe Hirnstimulation neben den eigentlichen dopaminergen Bahnen auch noch weitere neuronale Basalganglienschleifen beeinflußt. Zudem konnten wir bei den meisten Patienten eine unmittelbare Änderung der Tremorfrequenz innerhalb einer Sekunde nach Abschalten der tiefen Hirnstimulation nachweisen, was die Hypothese einer direkten Beeinflußung pathologischer Oszillationen im Bereich der Basalganglien stützt und gegen Neurotransmitter-assoziierte Prozesse als Wirkmechanismus der tiefen Hirnstimulation auf den Tremor spricht.
Perspektivisch analysieren wir mittels der hochauflösenden Bewegungsanalyse die Veränderungen verschiedener zeitlicher und räumlich-dreidimensionaler Tremorparameter in Folge einer tiefen Hirnstimulation, beispielsweise die Frequenz- und Amplitudenmodulationen des Tremors oder die Variabilität der Schlagrichtung der einzelnen Tremorschläge im Zeitverlauf.
Bewegungsanalyse bei Dystonie
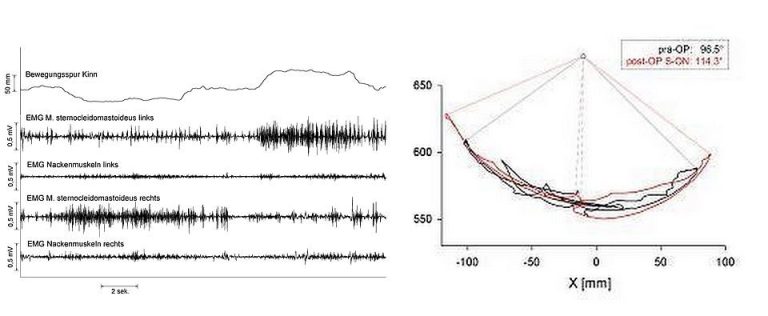
Beispielableitung einer horizontalen Kopfdrehung zunächst nach links, dann nach rechts bei einem einzelnen Patienten mit zervikaler Dystonie sowie Darstellung der Veränderung der maximalen horizontalen Kopfdrehung in der Transversalebene bei einem einzelnen Patienten präoperativ (schwarz) und postoperativ bei eingeschaltetem Stimulator (rot).
Bei Patienten mit einer Dystonie stellt der Schwerpunkt der wissenschaftlichen Arbeiten die Evaluation der therapeutischen Effektivität einer THS bei verschiedenen Unterformen primärer und sekundärer Dystonien, insbesondere bei der idiopathischen segmentalen Dystonie und der tardiven Dystonie dar. Mittels einer dreidimensionalen Bewegungsanalyse wird beispielsweise prospektiv die Beeinflußung der maximalen Kopfbeweglichkeit durch eine chronische Stimulation des Globus pallidus internus (GPi) bei Patienten mit zervikaler Dystonie untersucht. Des Weiteren werden für den klinischen Alltag relevante Aspekte wie Behandlungsalgorithmen, Batterielebensdauer der Aggregate in Abängigkeit von den eingestellten Stimulationsparametern, und Nebeneffekte einer tiefen Hirnstimulation des bei der Dystonie zumeist verwendeten Zielpunktes GPi untersucht. Von besonderem Interesse sind dabei hypokinetische Symptome wie Veränderungen des Schriftbildes im Sinne einer Mikrographie oder das Auftreten einer Gangstörung, teils mit „Freezing“-Episoden, welche bei einer chronischen Stimulation des posteroventralen Anteils des GPi auftreten können. Im Rahmen verschiedener weiterer Studien besteht eine Kooperation mit anderen Zentren für die tiefe Hirnstimulation (Neurologische / Neurochirurgische Universitätskliniken Hannover, Kiel, Berlin und Köln).
PERSPEKTIVE
Derzeit wird ein neues Ganganalysesystem etabliert, mit dem in Zukunft eine noch detailliertere Ganganalyse möglich sein wird. Das System ist funkbasiert und somit komplett mobil auch auf Station oder ambulant einsetzbar und umfasst parallel die sohlenbasierte Aufzeichnung der Fußdruckkurven mit Berechnung der entsprechenden Basis-Gangparameter, eine Aufzeichnung kinesiologischer Oberflächen-EMGs (bis zu 16 Kanäle), die Aufzeichnung verschiedener Gelenkwinkel im zeitlichen Verlauf und weitere akzelerometrische Spuren, beispielsweise zur Analyse von Rumpf- und Kopfbewegungen während des Gehens.
Ausgewählte Publikationen
- Macfarlane MD, Looi JC, Walterfang M, Spulber G, Velakoulis D, Styner M, Crisby M, Orndahl E, Erkinjuntti T, Waldemar G, Garde E, Hennerici MG, Bäzner H, Blahak C, Wallin A, Wahlund LO; LADIS Study Group. Shape Abnormalities of the Caudate Nucleus Correlate with Poorer Gait and Balance: Results from a Subset of the LADIS Study. Am J Geriatr Psychiatry 2015;23:59-71.
- Baezner H, Blahak , Hennerici MG. Motor, stance, and balance consequences of cerebral small vessel disease. In: Cerebral Small Vessel Disease. Eds. Pantoni L & Gorelick PB. Cambridge University Press. 2014.
- Alam M, Schwabe K, Lütjens G, Capelle HH, Manu M, von Wrangel C, Müller-Vahl K, Schrader C, Scheinichen D, Blahak C, Heissler HE, Krauss JK. Comparative characterization of single cell activity in the globus pallidus internus of patients with dystonia or Tourette syndrome. J Neural Transm 2014 [Epub ahead of print]
- Blahak, C, Bäzner H. Gangstörungen und Stürze bei älteren Patienten mit zerebraler Mikroangiopathie – Klinische Präsentation, Klassifikation, Diagnostik und Therapie. Aktuelle Neurologie 2014;41:107-115.
- Baezner H, Blahak C, Capelle HH, Schrader C, Lütjens G, Krauss JK. Transient global amnesia associated with accidental high-frequency stimulation of the right hippocampus in deep brain stimulation for segmental dystonia. Stereotact Funct Neurosurg 2013;91:335-337.
- Kreisel SH, Blahak C, Bäzner H, Inzitari D, Pantoni L, Poggesi A, Chabriat H, Erkinjuntti T, Fazekas F, Ferro JM, Langhorne P, O'Brien J, Scheltens P, Visser MC, Wahlund LO, Waldemar G, Wallin A, Hennerici MG. Deterioration of gait and balance over time: the effects of age-related white matter change--the LADIS study. Cerebrovasc Dis 2013;35:544-553.
- Brücke C, Huebl J, Schönecker T, Neumann WJ, Yarrow K, Kupsch A, Blahak C, Lütjens G, Brown P, Krauss JK, Schneider GH, Kühn AA. Scaling of movement is related to pallidal γ oscillations in patients with dystonia. J Neurosci 2012;32:1008-1019.
- Capelle HH, Blahak C, Schrader C, Baezner H, Hariz MI, Bergenheim T, Krauss JK. Bilateral deep brain stimulation for cervical dystonia in patients with previous peripheral surgery. Mov Disord 2012;27:301-304.
- Wöhrle JC, Blahak C, Capelle HH, Fogel W, Bäzner H, Krauss JK. Combined pallidal and subthalamic nucleus stimulation in sporadic dystonia-parkinsonism. J Neurosurg 2012;116:95-98.
- Blahak C, Capelle HH, Baezner H, Kinfe TM, Hennerici MG, Krauss JK. Micrographia induced by pallidal DBS for segmental dystonia: a subtle sign of hypokinesia? J Neural Transm 2011;118:549-553.
- Blahak C, Capelle HH, Baezner H, Kinfe TM, Hennerici MG, Krauss JK. Battery lifetime in pallidal deep brain stimulation for dystonia. Eur J Neurol 2011;18:872-875.
- Schrader C, Capelle HH, Kinfe TM, Blahak C, Bäzner H, Lütjens G, Dressler D, Krauss JK. GPi-DBS may induce a hypokinetic gait disorder with freezing of gait in patients with dystonia. Neurology 2011;77:483-488.
- Capelle HH, Schrader C, Blahak C, Fogel W, Kinfe TM, Baezner H, Krauss JK. Deep brain stimulation for camptocormia in dystonia and Parkinson's disease. J Neurol 2011;258:96-103.
- Reese R, Gruber D, Schoenecker T, Bäzner H, Blahak C, Capelle HH, Falk D, Herzog J, Pinsker MO, Schneider GH, Schrader C, Deuschl G, Mehdorn GM, Kupsch A, Volkmann J, Krauss JK. Long-term clinical outcome in Meige syndrome treated with internal pallidum deep brain stimulation. Mov Disord 2011;26:691-698.
- Blahak C, Capelle HH, Baezner H, Kinfe TM, Hennerici MG, Krauss JK. Micrographia induced by pallidal DBS for segmental dystonia: a subtle sign of hypokinesia? J Neural Transm 2011;118:549-553.
- Blahak C, Capelle HH, Bäzner H, Kinfe T, Hennerici MG, Krauss JK. Less is more: adaptation of voltage after battery replacement in deep brain stimulation for dystonia. Stereotact Funct Neurosurg 2010;88:311-314.
- Capelle HH, Blahak C, Schrader C, Baezner H, Kinfe TM, Herzog J, Dengler R, Krauss JK. Chronic deep brain stimulation in patients with tardive dystonia without a history of major psychosis. Mov Disord 2010;25:1477-1481.
- Blahak C, Bäzner H, Capelle HH, Wöhrle JC, Weigel R, Hennerici MG, Krauss JK. Rapid response of parkinsonian tremor to STN-DBS changes: direct modulation of oscillatory basal ganglia activity? Mov Disord 2009;24:1221-1225.
- Blahak C, Baezner H, Pantoni L, Poggesi A, Chabriat H, Erkinjuntti T, Fazekas F, Ferro JM, Langhorne P, O'Brien J, Visser MC, Wahlund LO, Waldemar G, Wallin A, Inzitari D, Hennerici MG. Deep frontal and periventricular age-related white matter changes but not basal ganglia and infratentorial hyperintensities are associated with falls - cross-sectional results from the LADIS study. J Neurol Neurosurg Psychiatry 2009;80:608-613.
- Blahak C, Wöhrle JC, Capelle HH, Bäzner H, Grips E, Weigel R, Kekelia K, Krauss JK. Health-related quality of life in segmental dystonia is improved by bilateral pallidal stimulation. J Neurol 2008;255:178-182.
- Bäzner H, Blahak C, Poggesi A, Pantoni L, Inzitari D, Chabriat H, Erkinjuntti T, Fazekas F, Ferro JM, Langhorne P, O'Brien J, Scheltens P, Visser MC, Wahlund LO, Waldemar G, Wallin A, Hennerici MG, on behalf of the LADIS Study Group. Association of gait and balance disorders with age-related white matter changes: the LADIS study. Neurology 2008;70:935-942.
- Blahak C, Wöhrle JC, Capelle HH, Bäzner H, Grips E, Weigel R, Hennerici MG, Krauss JK. Tremor reduction by subthalamic nucleus stimulation and medication in advanced Parkinson's disease. J Neurol 2007;254:169-178.
Urheberrecht © schlaganfall.org - Prof. Dr. M.G. Hennerici & Webmaster : M.R. Hennerici
Bilder fotolia: 74035623 - Stop Stroke Sign Painted, Open Hand Raised. © tashatuvango;36868741 - Schlaganfall © XtravaganT; 67101469 - Excellent Health Status Survey © Ivelin Radkov;83239124 - Teamwork! © stockpics;77601256 - Formula © olly
Alle Rechte vorbehalten.